Материал подготовлен Содиковым Исмоилом, инженером инновационно-технологического центра "Современные технологии переработки биоресурсов Севера".
Если вы нашли неточности в переводе, свяжитесь, пожалуйста, с Исмоилом. Вы можете написать Исмоилу, какие темы в области ЦБП вам интересны, и мы о них напишем. С Исмоилом можно связаться по телеграмму.

Если у вас есть интересные материалы и наработки, которыми вы хотели бы поделиться с коллегами, мы с радостью их опубликуем. Также мы ищем редакторов направлений Целлюлоза, Лайнеры, Другие картоны (специальные виды картонов). Если бы вы хотели писать и редактировать статьи на технические темы, свяжитесь с Ириной Летягиной.
Перекись водорода (H₂O₂) большинству знакома как антисептик из аптечки, но в промышленных масштабах она превращается в мощный окислитель, используемый для отбеливания целлюлозы на бумажных фабриках. В отличие от хлорсодержащих реагентов, перекись не образует вредных диоксинов и поэтому считается более экологичнойальтернативой. Но у неё есть и теневая сторона: при неправильных условиях она может стать источником взрывоопасной реакции. Случаи промышленного разложения с выбросом кислорода, пара и тепла не единичны, и каждое из таких происшествий связано с определёнными ошибками в проектировании или эксплуатации оборудования.
Эта статья — попытка простым языком объяснить, почему перекись может быть опасной, как её правильно использовать и какие уроки вынесли учёные из промышленных аварий.
В производстве целлюлозы отбеливание — это этап удаления остаточного лигнина (связанного с цветом), при этом важно сохранить прочность волокон и не загрязнить окружающую среду. Перекись водорода идеально подходит для финальной стадии отбеливания (например, D-E-P или D-E-P-E схемы), потому что она разрушает остаточные цветные соединения, не выделяя хлорорганику.
Однако при высокой концентрации (обычно используют 50%) она нестабильна и способна к самопроизвольному разложению, особенно в щелочной среде. Такое разложение сопровождается интенсивным выделением тепла и кислорода — в замкнутом объёме это может привести к эффекту паравзрыва.
В отбеливании перекись вводят в смесь вместе с каустической содой (NaOH), которая усиливает отбеливающий эффект. Но именно в такой смеси и скрыт риск.
Уравнение реакции простое:
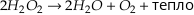
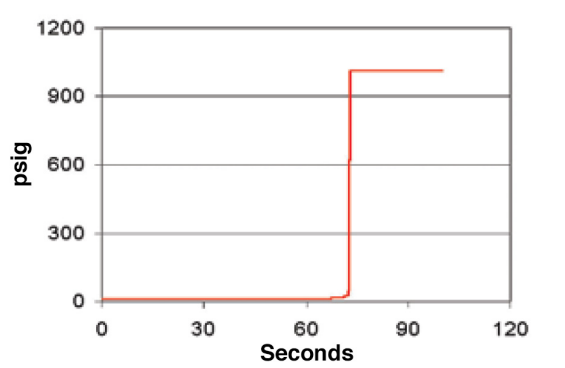
В присутствии щёлочи и ионов металлов, особенно железа, эта реакция резко ускоряется. Эксперименты, проведённые исследователями TAPPI, показали: при высокой температуре и без целлюлозы в системе реакция может начаться практически мгновенно. Уже через 10–20 секунд температура достигает точки кипения, и реакция входит в разгоняющуюся фазу (см. рис. 1). Это и есть "точка невозврата".
|
Рисунок 1. Динамическая модель, предсказывающая щелочное разложение пероксида водорода в вентилируемом смесительном сосуде. Условия были следующими: 25 л 50%-ного раствора пероксида водорода с добавлением 25%-ного раствора каустической соды |
В одном из тестов смесь 50% H₂O₂ и 25% NaOH в небольшом реакторе закипела за 40 секунд при начальной температуре 50 °C — и это без учёта промышленного объёма.
Оказалось, что главным катализатором таких реакций являются ионы железа. Даже содержание 0.5–5 ppm (миллионных долей!) способно ускорить реакцию в несколько раз. Проблема в том, что железо содержится в каустической соде как примесь — и чем ниже её химическая чистота, тем выше риск.
Учёные сравнили три сорта каустика:
- Hg-cell (соль, полученная через ртутный электролиз) — высокая чистота, минимальные риски.
- Membrane-grade — средний уровень примесей.
- ET-grade — с наибольшим содержанием железа.
Именно в ET-каустике реакции шли быстрее всего, а опасный диапазон смесей (в котором возможна автоускоренная реакция) оказался значительно шире. См. диаграммы на рис. 2-4, где показано, как зона риска сдвигается в сторону водной вершины, охватывая даже сильно разбавленные смеси.
Рисунок 2. Результаты моделирования реакции для каустической соды на основе ртутных элементов. Для смеси, температура которой начинается с 50°C, контуры обозначают время, необходимое для достижения температуры 100°C. Синяя линия обозначает рабочую линию для типичной работы мельницы. Розовая линия - это предлагаемая нами более безопасная рабочая линия.
| |
Рисунок 3. Результаты моделирования реакции для каустической соды мембранного производства. Для смеси, температура которой начинается с 50°C, контуры обозначают время, необходимое для достижения температуры 100°C. Синяя линия обозначает рабочую линию для типичной работы мельницы. Розовая линия - это предлагаемая нами более безопасная рабочая линия. |
Рисунок 4. Результаты моделирования реакции для каустической соды марки ET. Для смеси, температура которой начинается с 50°C, контуры обозначают время, необходимое для достижения температуры 100°C. Синяя линия обозначает рабочую линию для типичной работы мельницы. Розовая линия - это предлагаемая нами более безопасная рабочая линия. |
Большинство аварий происходит в момент остановки потока массы. Пока целлюлоза проходит через насос, перекись и каустик быстро расходуются. Но если поток внезапно прекращается (например, из-за остановки машины), перекись и щёлочь продолжают поступать, накапливаются в одном месте — и запускается опасная реакция. Именно так произошли аварии на предприятиях в США (Evadale mill, 2001; Prince George mill, 2007), когда перекись собралась в насосе и вызвала взрыв.
Как избежать катастрофы: практические советы
На основе полученных данных исследователи предлагают следующее:
- Разбавляйте перекись до 10% перед введением в процесс. Даже в присутствии щёлочи и железа такая концентрация не создаёт условий для цепной реакции.
- Используйте более чистый сорт каустика (Hg-cell или membrane). Содержание железа — ключ к безопасности.
- Проектируйте установку так, чтобы перекись никогда не стояла в неподвижном состоянии. Это значит — автоматическая остановка подачи реагентов при остановке потока массы, а также промывка насосов и патрубков.
- Прописывайте чёткие протоколы запуска и остановки оборудования. Например, перед остановкой системы должны быть откачаны остатки реагентов, а насосы промыты водой.
- Контролируйте температуру. Повышение температуры до 40–50 °C уже ускоряет реакцию — важно избегать нагрева.
Разбавление перекиси и использование более чистой соды на первый взгляд может показаться затратным. Но это плата за безопасность и устойчивость. Предотвращение даже одного взрыва с разрушением оборудования и простоем линии обойдётся дешевле, чем ликвидация последствий. Кроме того, разбавленная перекись легче распределяется, вызывает меньше коррозии и опасна при контакте с кожей или глазами значительно меньше.
Как показало исследование, даже широко применяемый и на первый взгляд безопасный реагент может нести риск, если не учитывать условия его применения. Перекись водорода — мощный инструмент в отбеливании, но он требует инженерной культуры, чёткого понимания химии и продуманного проектирования.
Промышленные аварии должны служить напоминанием: безопасность — это не следствие удачи, а результат знаний, моделирования и строгого соблюдения технологических норм.